【
儀表網 研發快訊】近日,中國科學技術大學閆立峰教授團隊在腫瘤超亮成像引導的光熱治療方面取得重要進展。光療,尤其是光動力療法(PDT)和光熱療法(PTT)已成腫瘤的前沿治療手段。結合熒光成像和導航手術技術,對腫瘤的精準診療具有重要價值。但常規的染料熒光發射波長短,組織自吸收和背景熒光嚴重,限制了其組織穿透深度和成像分辨率。近紅外二區(NIR-II)熒光具有優異的組織穿透性,同時光吸收和散射極低,成為光療中光敏劑的理想工作波段。然而,大多數已報道的NIR-II熒光探針通常表現出較低的量子產率。因此,開發高亮度新型NIR-II熒光分子仍然是亟待解決的問題。與傳統光敏劑染料不同,穩定有機自由基的開殼分子特性使其具有獨特的電子構型和窄帶隙特性,展現出更優越的光物理性能。在激光激發下,自由基可經歷D0→D1態躍遷,打破單重態與三重態之間的系間穿越勢壘,從而有望顯著提高熒光量子產率。
在該研究中,研究人員通過將久洛尼定基團引入到雙氰甲基功能化的吩惡嗪骨架中,開發了一種新型穩定有機自由基染料CNPJ。首先通過核獨立化學位移計算證實了CNPJ的穩定性和自由基性質。結構分析揭示了兩個由有效的自旋離域和分子間電荷轉移引起的臨界現象:i )極性觸發的自由基中心重新分布和ii )熱調節的單體- π二聚體平衡。這些顯著的特征賦予了增強的結構剛性和優異的絕對光致發光量子產率( 2.57 %),遠高于常規報道的NIR-II染料。基于這些特性,進一步聯合pifithrin - μ ( PES )抑制劑介導,將CNPJ與pH響應的兩親性聚合物PEA結合,構建了一個診療一體化平臺。該系統實現了超高亮度熒光成像引導的溫和光熱腫瘤治療,取得了良好的治療效果。相關研究成果以“Central Dynamic Conversion of Dicyanomethyl Radicals via Inter. .molecular Charge Transfer for Ultrabright NIR-II Fluorescence Imaging-Guided Mild Photothermal Therapy ”為題發表于《德國應用化學》雜志(Angew. Chem. Int. Ed. 2025,e202509609)。
在不同極性溶劑中,CNPJ分別呈現出C自由基和N自由基信號,表明其具有極性微環境誘導的分子間電荷轉移特性。該自由基信號強度隨溫度的變化也驗證了其溫度依賴性的可逆聚合-解離行為。變溫紫外吸收光譜中隨溫度變化而出現的長波長新吸收峰,證明了CNPJ在聚合過程中優先發生π-二聚化而非σ-二聚化。Van't Hoff曲線擬合得到的熱力學參數也證實了這一點。基于這些機制,結構剛性增強的CNPJ分子表現出高的絕對熒光量子產率。
圖1.CNPJ及其納米粒子的自由基性能表征
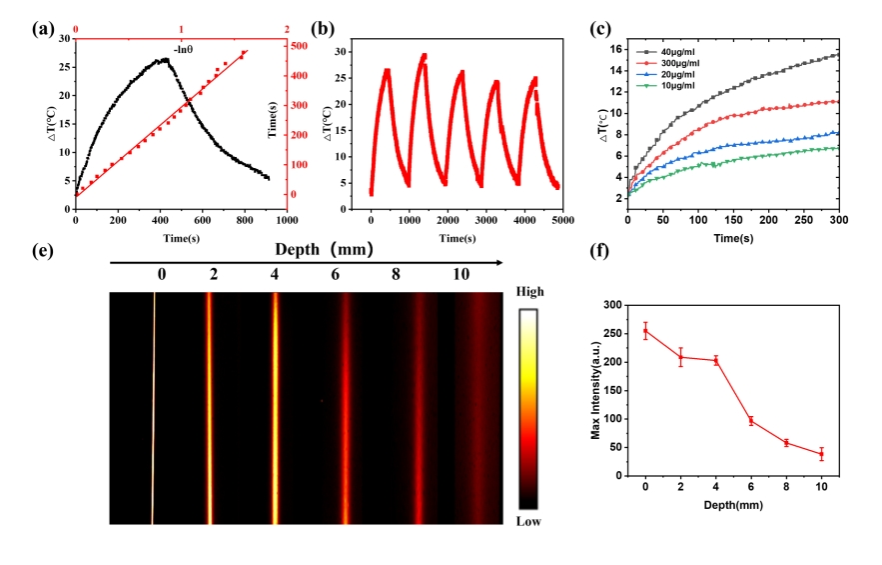
研究者測試了納米粒子的光熱穩定性,并計算出其光熱轉換效率(PCE)為49.33%。隨后,利用脂肪乳試劑模擬生物組織進行了熒光穿透深度測試。如圖2所示,在808 nm激光輻照下觀測到的顯著溫升,以及在深度達10 mm時依然清晰的熒光邊界,共同表明CNPJ納米粒子能夠實現深層組織的高穿透熒光成像引導光熱效應。
圖2.納米粒子光熱性能及穿透深度表征
隨后基于前期體外光物理特性研究,系統評估了納米顆粒的體內藥代動力學特征及腫瘤靶向效能。經尾靜脈注射給藥(5 mg/kg)后,模型動物在6小時內即可實現清晰的腫瘤邊緣顯影。定量熒光追蹤顯示納米顆粒在腫瘤區域呈漸進性蓄積,并于24小時達峰值,較6小時時增強2.4倍。隨后,研究者按照圖3所示方案將該納米顆粒注射至荷瘤小鼠體內進行光熱治療研究。利用
紅外熱像儀進行實時溫度監測,確保在整個輻照過程中腫瘤部位溫度始終低于48°C閾值。在808 nm激光照射約3分鐘后,可以清晰觀察到腫瘤的光熱成像,隨即調節光功率密度以將腫瘤溫度維持在48°C以下,完成m-PTT。治療后對腫瘤體積和小鼠全身狀態的監測持續了14天,所有實驗組小鼠均未見明顯異常。
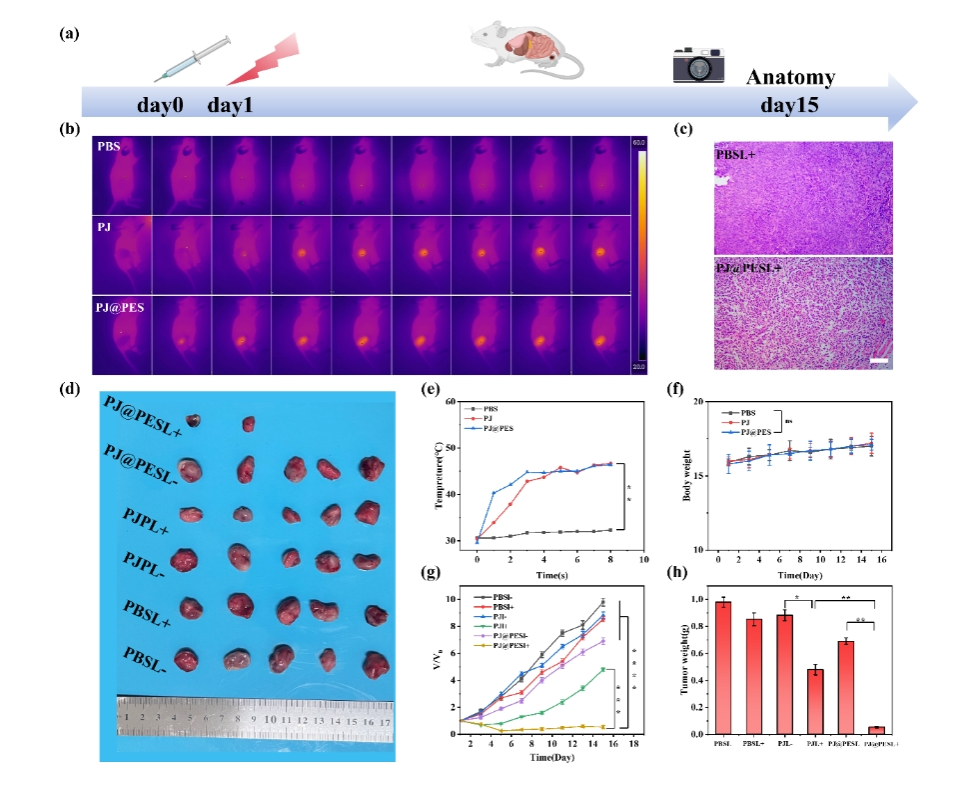
圖3.體內溫和光熱治療
該項研究受到科技部、國家自然科學基金委、中國科學院等項目資助。閆立峰教授為該論文的通訊作者,博士生續藝漩為第一作者,附一院尹大龍教授團隊共同參與該項研究。





所有評論僅代表網友意見,與本站立場無關。